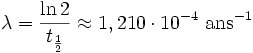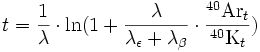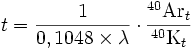En géologie, on a besoin de dater notamment les roches, les fossiles, les minéraux, et bien sûr, la Terre…
La datation est le résultat d’une étude effectuée sur un objet dont on cherche à déterminer l’âge précis.
Principes généraux
Par le passé, aucune méthode scientifique fiable n’était disponible et la datation ne pouvait se faire que par rapport à des textes historiques parlant de l’objet, des comparaison avec d’autres objets similaires d’âge connu ou des inscriptions figurant sur celui-ci.
À partir du début du XIXe siècle, la méthode stratigraphique se développa, elle consistait en une datation relative des vestiges, découverts in situ, les uns par rapport aux autres suivant les couches du terrain exploré ou par rapport à un témoin d’âge connu.
Au XXe siècle, de nombreuse techniques de plus en plus complexes apparurent qui permirent une datation absolue.
Elles sont répertoriées en quatre groupes principaux :
– Méthodes basées sur des phénomènes radioactifs (datation radioactive) :
— Carbone 14 ;
— Potassium/Argon ;
— Uranium/Thorium.
– Méthodes basées sur des défauts cristallins :
— Thermoluminescence ;
— Résonance de spin électronique ;
— Traces de fission.
– Méthode basée sur des phénomènes de diffusion :
— hydratation de l’obsidienne.
– Méthodes basées sur des phénomènes cycliques :
— Dendrochronologie, basée sur l’analyse en épaisseur et le comptage des anneaux de croissance des arbres.
— Archéomagnétisme, basée sur la variation du champ magnétique terrestre enregistré par les minéraux magnétiques présents dans l’argile.
Datation radioactive
Les premiers essais de datation radioactive coïncident quasiment avec les premiers pas de la radioactivité sur la scène scientifique. La datation semble une des applications les plus naturelles de la radioactivité. La désintégration d’un élément radioactif obéit à la loi de décroissance exponentielle formulée en 1902 par Ernest Rutherford et Frederick Soddy.
Ce phénomène régulier permet en principe de dater des événements que l’on peut associer à la production ou à l’accumulation d’un élément radioactif en un lieu donné et dont l’âge est de l’ordre de grandeur de la demi-vie de cet élément.
Dès 1905, dans son cours à l’université de Yale, Rutherford propose de dater des minéraux grâce à la radioactivité : « L’hélium observé dans les minéraux radioactifs est presque certainement dû à sa production par le radium et les autres substances radioactives contenus dans ces minéraux. Si le taux de production de l’hélium en fonction du poids des divers radioéléments était connu expérimentalement, il devrait être possible de déterminer l’intervalle de temps requis pour produire la quantité d’hélium observée dans des minéraux radioactifs, ou, autrement dit, de déterminer l’âge du minéral » (traduction de G.B. Dalrymple, The age of the Earth, Stanford University Press, Stanford, 1991, pp.70-71).
La datation au carbonne 14
La datation au carbone 14 est une méthode de datation radioactive basée sur la mesure de l’activité radiologique du carbone 14 contenu dans de la matière organique dont on souhaite connaître l’âge absolu depuis sa mort.
Le domaine d’utilisation de cette méthode correspond à des âges absolus de quelques centaines d’années jusqu’à environ 50 000 ans. L’application de cette méthode à des événements anciens, tout particulièrement lorsque leur âge dépasse 6 000 ans (préhistoriques), a permis de les dater beaucoup plus précisément qu’auparavant. Elle a ainsi apporté un progrès significatif en archéologie et en paléoanthropologie.
Historique
En 1960, Willard Frank Libby a reçu le prix Nobel de chimie pour le développement de cette méthode (cf. Willard Frank Libby pour l’histoire de cette découverte).
Principe de la datation
Le carbone 14 (14C) ou radiocarbone est un isotope radioactif du carbone dont la période radioactive (ou demi-vie) est égale à 5740 ans.
Un organisme vivant assimile le carbone sans distinction isotopique. Durant sa vie, la proportion de 14C présent dans l’organisme par rapport au carbone total (12C, 13C et 14C) est la même que celle existante dans l’atmosphère du moment.
La datation au carbone 14 se fonde ainsi sur la présence dans tout organisme de radiocarbone en infime proportion (de l’ordre de 10-12 pour le rapport 14C/C total). A partir de l’instant où meurt un organisme, la quantité de radiocarbone qu’il contient ainsi que son activité radiologique décroissent au cours du temps selon une loi exponentielle. Un échantillon de matière organique issu de cet organisme peut donc être daté en mesurant soit le rapport 14C/C total avec un spectromètre de masse, soit son activité x années après la mort de l’organisme.
Origine du radiocarbone naturel
Le radiocarbone naturel circule dans trois réservoirs : l’atmosphère, les océans et la biosphère.
Avec une période radioactive de 5730 ans, le radiocarbone aurait depuis longtemps disparu de la biosphère s’il n’était produit en permanence.
Dans la haute atmosphère, des réactions nucléaires avec les protons du rayonnement cosmique produisent des neutrons. Après avoir été ralentis par collision avec les molécules de l’air, les neutrons réagissent avec l’azote pour former du radiocarbone : n + 14N → 14C + 1H
Cette réaction est privilégiée du fait que l’azote constitue 78,11 % de l’atmosphère de la terre. C’est entre 7000 mètres et 12 000 mètres que la production de radiocarbone a lieu.
Le radiocarbone réagit rapidement avec l’oxygène pour former du dioxyde de carbone. Ce gaz circule dans toute l’atmosphère et se dissout dans les océans pour former des carbonates. Du radiocarbone circule donc aussi dans les océans.
Le dioxyde de carbone réagit également avec la biosphère. Les plantes assimilent du radiocarbone dans l’atmosphère par photosynthèse et elles sont mangées par les animaux. Les organismes marins assimilent également le radiocarbone présent dans les océans. Le radiocarbone se répand donc dans la biosphère tout au long de la chaîne alimentaire.
Le rapport 14C/C total est considéré comme uniforme dans l’atmosphère, la surface des océans et la biosphère en raison des échanges permanents entre les organismes vivants et leur milieu.
De plus, on suppose que le flux de rayons cosmiques est constant sur une longue période de temps. Par conséquent, le taux de production du radiocarbone est constant, donc le rapport 14C/C total dans l’atmosphère, la surface des océans et la biosphère est constant (le nombre d’atomes produits égale le nombre d’atomes qui se désintègrent).
À la mort d’un organisme, tout échange avec le milieu extérieur cesse mais du radiocarbone reste piégé et sa quantité se met à décroître exponentiellement selon le processus de la décroissance radioactive : ceci permet de savoir depuis combien de temps l’organisme est mort.
Mesure de l’âge d’un échantillon de matière organique
La désintégration radioactive du carbone 14 obéit à une loi de décroissance exponentielle caractérisée par sa demi-vie. Dater un échantillon de matière organique consiste à mesurer le rapport 14C/C total (ce qui reste de radiocarbone naturel suite à la désintégration) et à en déduire son âge. Le rapport 14C/C total est mesuré soit indirectement par la mesure de l’activité spécifique (nombre de désintégrations par unité de temps et par unité de masse de carbone) due au radiocarbone naturel qui est proportionnelle au rapport 14C/C total, soit directement par spectrométrie de masse.
Quand elle fut mise au point par Libby à la fin des années 1940, la datation au carbone 14 passait par la mesure de la radioactivité des échantillons ce qui était délicat du fait de la faiblesse du signal (il y a peu d’atomes de radiocarbone dans l’échantillon analysé, surtout après quelques milliers d’années, et encore moins qui se désintègrent) et du bruit de fond (radioactivité naturelle, rayons cosmiques,…)
Aujourd’hui, la mesure directe du rapport 14C/C total par spectrométrie de masse est privilégiée car elle permet de dater des échantillons beaucoup plus petits (moins d’un milligramme contre plusieurs grammes de carbone auparavant) et beaucoup plus vite (en moins d’une heure contre plusieurs jours ou semaines). Le carbone extrait de l’échantillon est d’abord transformé en graphite, puis en ions qui sont accélérés par la tension générée par un spectromètre de masse couplé à un accélérateur de particules. Les différents isotopes du carbone sont séparés grâce à un aimant ce qui permet de compter les ions de carbone 14.
Les échantillons vieux de plus de 50 000 ans ne peuvent être datées au carbone 14 car le rapport 14C/C total est trop faible pour être mesuré par les techniques actuelles ; et un âge inférieur à 35 000 ans est indispensable pour une bonne précision.
La méthode la plus courante de datation consiste à déterminer la concentration Ct de radiocarbone (c’est-à-dire le rapport 14C/C total) d’un échantillon à l’instant t de mesure ; l’âge de l’échantillon est alors donné par la formule :
où C0 est la concentration de radiocarbone de l’échantillon à l’instant t0 de la mort de l’organisme d’où provient l’échantillon (
Période radioactive conventionnelle
L’âge carbone 14 conventionnel d’un échantillon de matière organique est calculé à partir d’une période conventionnelle de 5568 ans, calculée en 1950 à partir d’une série de mesures. Depuis, des mesures plus précises ont été réalisées, et donnent une période de 5730 ans mais les laboratoires continuent à utiliser la valeur conventionnelle pour éviter les confusions.
Les résultats sont donnés en années « before present » (BP). Le point zéro (à partir duquel est mesuré le temps écoulé depuis la mort de l’organisme dont cette matière est issue) est fixé à 1950, en supposant un niveau de radiocarbone égal à celui de 1950 car depuis la pollution a grandement modifié le taux atmosphérique du dioxyde de carbone !
Courbes d’étalonnage
Au début des années 1960, certaines divergences systématiques observées entre l’âge d’échantillons estimé par la datation au carbone 14 et par l’archéologie ou la dendrochronologie posent problème.
Suite aux variations du champ magnétique terrestre, le taux de production du radiocarbone naturel a varié au cours du temps.
Les changements climatiques ainsi que le rejet massif de carbone fossile dans l’atmosphère par l’industrie et les transports ont également modifié la quantité totale de carbone dans les trois réservoirs (atmosphère, océans et biosphère). Enfin, durant les années 1950 et 1960, les essais nucléaires ont presque doublé la quantité de radiocarbone dans l’atmosphère.
Par conséquent, le rapport 14C/C total dans la biosphère n’est pas constant dans le temps. Il est donc nécessaire de construire des courbes d’étalonnage en confrontant les datations obtenues grâce au carbone 14 et les datations par d’autres méthodes telles que la dendrochronologie.
Ces courbes permettent, connaissant l’âge carbone 14 conventionnel d’un échantillon, de trouver la date correspondante dans notre calendrier.
Les véhicules équipés de moteurs à combustion interne utilisent des produits pétroliers qui ne contiennent que des isotopes stables du carbone, 12C et 13C ; la totalité du carbone 14 ayant disparu au cours de la longue durée d’enfouissement des combustibles fossiles.
Ce sera également le cas des gaz carbonés rejetés par ces véhicules ; ainsi, la datation au 14C d’un arbuste poussant en bordure des autoroutes pourra fréquemment lui attribuer un âge de douze mille ans ou plus.
Des tables de correction existent donc pour permettre des datations liées à la révolution industrielle, en fonction des lieux d’émissions de gaz carbonés dépourvus en 14C, issus de combustibles fossiles.
Datation au potassium-argon
La datation au potassium-argon est une méthode de datation radioactive qui permet de déterminer l’âge d’un échantillon de roche par la mesure des concentrations relatives du couple d’isotopes potassium 40 / argon 40.
Le potassium 40 est un isotope radioactif qui se désintègre suivant les modes de désintégration suivants :
λε = 0,581.10-10/an
λβ = 4,962.10-10/an
Description de la méthode
La méthode de datation K-Ar s’applique à une roche provenant de la solidification d’un magma entièrement dégazé, et repose sur l’hypothèse que cette roche ne contenait pas d’argon au moment de sa formation.
Une datation de la roche est possible quand l’un des minéraux la constituant contient du potassium, et que le minéral a piégé la totalité de l’argon formé lors de la désintégration du 40K.
Les minéraux sont alors datés en mesurant les concentrations du potassium 40, et de l’argon 40 accumulé. La période radioactive du potassium 40 est de 1,25 milliard d’années ; la méthode permet ainsi de dater des roches couvrant la quasi totalité des ages géologiques avec une bonne précision.
Les minéraux les mieux adaptés à cette méthode sont la biotite, la muscovite et les feldspaths.
La datation au potassium-argon permet de dater les minéraux :
– des roches métamorphiques ;
– des roches volcaniques.
Le dosage du potassium 40 et de l’argon 40 nécessite l’emploi de techniques raffinées de spectrométrie de masse effectuées dans des laboratoires spécialisés.
Calcul de l’âge de la roche
L’âge de l’échantillon est obtenu au moyen de la formule suivante :
Lorsque le rapport des concentrations d’argon 40 et de potassium 40 est suffisamment faible, la formule se simplifie en :
t étant l’âge de l’échantillon, 40Kt et 40Art les quantités mesurées des isotopes père et fils.
Datation radioactive et géologie
La maîtrise du temps transforme la géologie. L’étude des couches de terrain superposées (ou stratigraphie) donne l’âge relatif des couches, à savoir leur ordre chronologique, mais pas leur durée ou leur ancienneté à part des estimations grossières qui supposent une vitesse de formation constante.
Par contre, la datation de minéraux contenant des éléments radioactifs de longue demi-vie donne, dès la fin des années 1910, une estimation raisonnable des durées géologiques en âge absolu (de l’ordre de 100 millions d’années), c’est-à-dire qu’il devient possible de délimiter les durées géologiques à l’aide de repères temporels sur l’axe d’un calendrier.
Mesure de l’âge de la Terre
Depuis le XIXe siècle, la question de l’âge de la Terre est un sujet de controverse passionnée. En 1921, Henry N. Russell suppose qu’une large portion de la croûte terrestre peut être traitée comme un réservoir unique et datée grâce au rapport entre parents radioactifs (uranium et thorium) et descendants stables (plomb) en supposant que la roche ne contient pas de plomb lors de sa formation. Il calcule un âge de la Terre compris entre 1 et 8 milliards d’années. Un comité sur l’âge de la Terre formé en 1931 conclut à la supériorité de la nouvelle méthode de datation de la Terre sur les anciennes.
Suite à l’étude par Alfred O. Nier des isotopes du plomb (1938) puis au modèle proposé par Arthur Holmes et Friedrich Houtermans (1946), les travaux sur l’âge de la Terre aboutissent dans les années 1950 lorsque les chercheurs disposent de tous les outils nécessaires : la connaissance de la chaîne de désintégration des isotopes naturels de longue demi-vie (de l’ordre du milliard d’années) ainsi que les bons instruments de mesure.
Comme la roche primordiale a été entièrement détruite par les mouvements de l’écorce terrestre et les processus sédimentaires, les tentatives de mesure directe de l’âge de la Terre sont vouées à l’échec.
En 1956, Clair Patterson utilise la méthode uranium/plomb pour dater une météorite en supposant qu’elle vient d’une planète formée à peu près en même temps que la Terre et estime l’âge de la Terre à 4,55 milliards d’années à 70 millions d’années près.
Actuellement, l’âge de la Terre est estimé à 4550 millions d’années, soit début de l’Hadéen. Les roches les plus anciennes connues ont un âge d’environ 4 milliards années ; rares sont celles dont l’âge dépasse 3 milliards années. Les plus anciens fossiles témoignent de l’existence d’organismes il y a 3,9 milliards d’années.